新聞資訊
新聞資訊
- 微通道反應器如何放大?微通道反應器放大方式
- 連續流反應器有哪些材質?連續流反應器材質類型
- 碳化硅材質動態管式反應器優缺點,碳化硅動態管反應器優缺點分析
- 不銹鋼材質微通道反應器優缺點,不銹鋼材質微反應器優缺點分析
- 合金材質微通道反應器有哪些?合金材質微通道反應器類型
聯系我們
手機:19314072625
電話:400-172-8090
郵箱:kxwlhg@163.com
地址:安徽省合肥市高新區永和路597號綠城科技園E棟6樓
微化知識
芳環親電取代的見解
- 作者:楊海軍
- 發布時間:2024-04-12
- 點擊:2371
在化學合成中,很多芳香化合物及其衍生物的合成存在很多問題和挑戰。為了使得產品具有獨特的化學性質,需要向芳環上添加各式各樣的取代基團。從電子理論出發,化學反應的本質是電子的遷移和耦合,芳環是一個特殊的結構,他的電子云相互重疊組成共軛結構,其化學性質則由整體共軛結構所決定。例如:苯環(包括其它芳環)上若事先已經連接了其他基團,則這個基團會對后繼的親電取代反應造成明顯的影響。下圖是常規取代基取代苯環后的各位點的電子云密度:
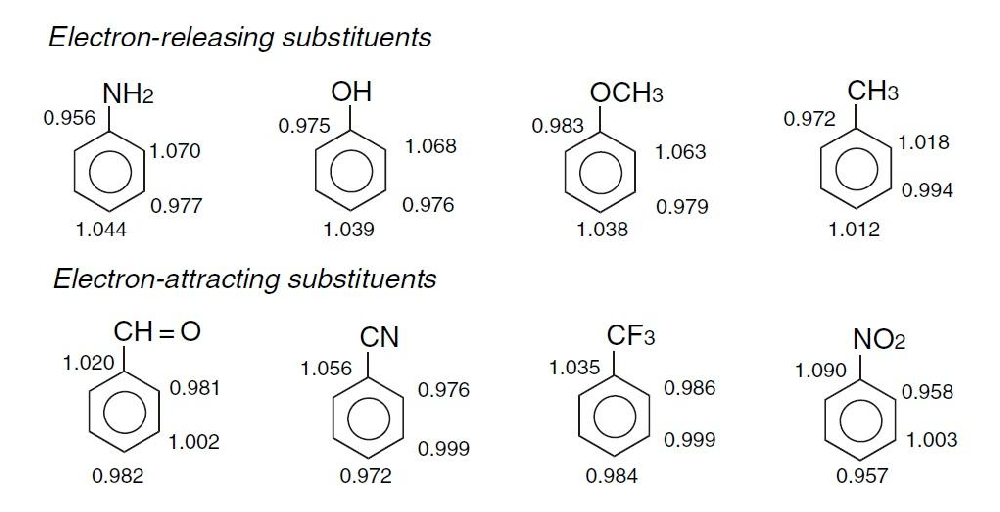
由圖可知我們可將取代基大致分為兩類:致活取代基和致鈍取代基,兩類取代基又將對后續的其他取代基的加入產生如下影響:
①對后繼親電取代反應速率的影響:此基團存在時,反應速率比沒有此取代基更快(致活)還是更慢(致鈍)
②對后繼親電取代位置的影響:主要發生在此基團的鄰對位(鄰對位定位基)還是間位(間位定位基)。
從反應機理的角度,我們實際可以通過如下原則判斷特定基團這兩方面的效應:活性效應:(反應前)基團使得苯環上電子云密度發生了怎樣的變化,升高抑或降低?定位效應:(反應中)基團對鄰、間、對位取代后各自生成的正離子中間體穩定性如何?注意,這里決定活性與定位這兩種效應的時機不同,前者主要看反應前的底物分子,后者主要與反應中生成的正離子中間體有關。以下我們對這兩種效應分別進行討論。
1.對活性的影響:
已有基團對后繼親電反應活性的影響其實很簡單。注意到我們接下來要發生的是親電取代,進攻試劑缺電子,奔著芳環上較高密度的電子云過來,因此我們也很容易想象,若既有基團推電子,能使芳環電子云密度進一步升高,則后繼反應速率上升,該基團致活;反之若既有基團吸電子,使得芳環電子云密度下降,則將增大后繼反應的困難,該基團致鈍。歸根結底,還是看基團的電性效應。而我們知道一個基團的電性效應又分為誘導、共軛兩個方面。基團連接在芳環旁側時,通常總會有誘導效應。某些基團原子又有垂直于芳環的p軌道,也能與芳環形成共軛,則同樣會具有共軛效應。考查給/吸電子能力時,我們經常需要綜合考慮I/C這兩方面的影響。
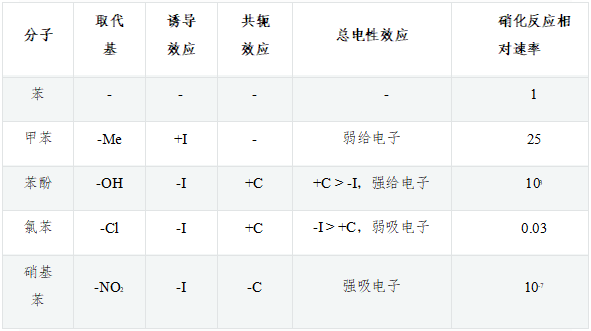
如下圖,苯及其一系列單取代衍生物進行硝化反應,相同條件下若以苯的反應速率為基準,則甲苯、苯酚速率均較苯高而氯苯、硝基苯均較苯為低:
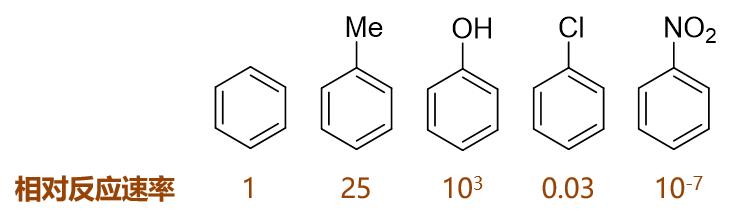
這些單取代苯反應活性上呈現出明顯的區別,毫無疑問,與取代基團的電性效應直接相關,以下具體分析。
甲苯:作為烷基,甲基明顯具有給電子誘導效應+I。而甲基碳sp3雜化,與苯環間并無共軛,因而不存在共軛效應。總體電性效應上,甲苯中的甲基是個不太強的給電子基團(單純通過誘導效應給/吸電子,通常強度都不會特別大),因而其反應速率稍高于苯。
苯酚:羥基與苯環直接相連。誘導效應上,O的電負性較高,明顯吸電子(-I)。但同時需要留神,羥基O原子這里會采取sp2雜化,與苯環之間存在共軛,因此我們還需要考慮共軛效應。有機分子中,若經典結構式上原子直接連接單根雙鍵(如C=O中的O),則該原子一般總會采取sp2雜化。此外,經典結構式中只連接單鍵的雜原子,很多情況下雜化形態也會是sp2。由于共軛形成電子離域體系后能夠使整個分子能量下降,因此當此類雜原子與雙鍵、芳環碳相鄰時(如此例中的羥基O),一般也會采取sp2雜化狀態,使自己的p軌道能夠參與到共軛中去。對于O而言,外層6電子,采取sp2雜化后這六個電子的排布如下圖所示,sp2雜化軌道中有兩根軌道存在未成對電子,這兩根剛好分別于氫及苯環上的碳原子形成兩根σ鍵(也就是結構式中的O-C、O-H單鍵)。除此之外,還有兩對孤對電子,其中sp2雜化軌道上的那對與O-C、O-H鍵共面,也就是與苯環共面,無法與苯環碳的p軌道側面交疊。但未參與雜化的另有一對電子的p軌道,恰好垂直于sp2及苯環的平面,剛好與苯環碳的p軌道平行,能夠側面交疊參與到共軛中去。因此這兒氧原子兩對孤對電子里只有一對能參與到共軛里去,如下圖所示。
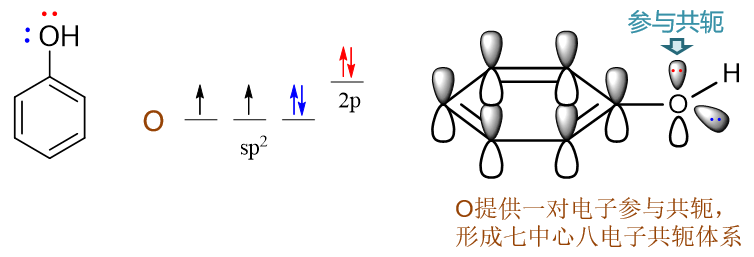
通常單個原子無法使自己的兩根軌道同時處于平行狀態,因而最多只能提供一根軌道參與共軛,共軛的電子數目不會超過兩個。氧提供了兩個共軛的π電子,而苯環上六個碳,我們很熟悉,每個碳一個π電子,湊到一塊兒這七個原子總共會有八個電子形成共軛體系,也即 形成了Π78。粗略里看,每個原子差不多分到8/7個π電子。而氧參與共軛之前,如果光是苯環,明顯是Π66,每個碳平均只有一個π電子。兩相比較,在O參與共軛后,苯環的碳原子上電子云密度明顯上升了,相當于O通過共軛作用,把自己的兩個π電子推向了苯環。這其實也就是我們之前就已經了解的給電子共軛效應(+C)。
當前羥基氧的誘導、共軛效應剛好是相反的,一個吸電子一個給電子。在絕大多數場合下,共軛效應都是要強于誘導效應的, 而且往往是遠強于(當然也有例外,我們馬上就能看到)。因此兩相疊加,整體上羥基連接在苯環旁側時是個很強的給電子基團, 會使得苯環上親電取代反應活性大大升高,不單強過單純的苯環,甚至較甲苯的反應速率也高得多。電中性雜原子參與共軛時提供的p電子數目一般可依據如下原則計算:若其直接連接雙鍵(如羰基C=O中的氧原子),此時形成的一般是π-π共軛,則一般提供一個π電子;若與其直接相連的僅有單鍵(如上例中的羥基氧),此時形成的一般是p-π共軛,則一般提供兩個π電子。
氯苯:氯連接在苯環旁側的效應與剛才的苯酚相仿。誘導明顯還是吸電子,而共軛依然是給電子。Cl外層7個電子,采取sp2雜化 后的電子排布如下圖所示,其中sp2雜化軌道上的未成對電子用來與苯環碳間形成單鍵,而也僅有未參與雜化的p軌道可以 加入共軛,提供一對電子,同樣形成Π78共軛體系。
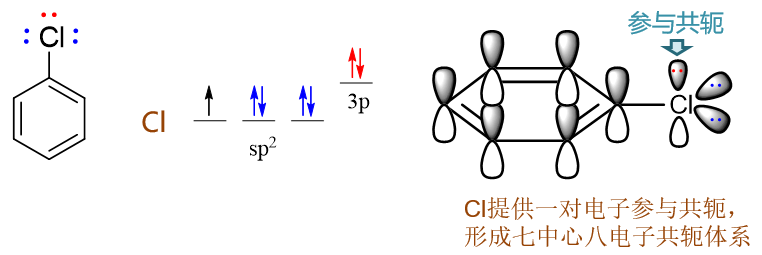
但與之前的氧相比,鹵素原子電負性通常更強,當其與電中性的碳共軛體系(如這里的苯環)相連時,往往誘導效應要強于共軛效應。兩相疊加,鹵素原子這里總體上會體現出弱吸電子的特征。氯苯的親電反應活性也就因之略低于苯。對絕大多數與碳原子相連的雜原子而言,如果存在共軛,則共軛效應強度會高于誘導效應。但與電中性碳相連的鹵素是個例外。至于為什么要強調電中性碳,后面對定位效應的討論中大家會進一步理解。
硝基苯:誘導效應依然容易分析,N、O電負性較高,明顯-I。同時,硝基中的N、O原子實際也都采取sp2雜化,也能參與共軛。此處硝基與苯環共軛的情況較為復雜,我們只做 簡明的討論。硝基苯中硝基的結構基本如下圖所示,它的經典結構式較為特殊,右側一根N-O鍵上一對電子由N提供,而非正常共價鍵 一人出一個電子的模式。因此這里氧相當于多接受一個電子,帶負電荷,而氮多提供一個電子,帶正電荷(即所謂的“形式電荷”)。
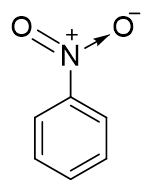
既然是這么一個電子狀態,明顯硝基中N原子極度缺電子,具有強烈的從別處拉來電子的趨勢,尤其與苯環共軛之后。我們知道共軛體系 π電子不是定域而是可以離域自由流動的,流動性非常高,當前N又特別能拉,電子云無疑會從苯環向氮原子處移動。也就是說,通過共軛,氮上電子云密度上升而苯環電子云密度下降了,因此這兒硝基將具有相當強的共軛吸電子效應-C。
誘導、共軛均吸電子,整體上硝基也是個極強的吸電子基團——在常見電中性基團中基本是最強的一個。這一組分子里,硝基苯自然反應活性最低。這組分子的電性效應、反應活性情況,歸納起來大致如下表所示。
除了這四種基團外,其它常見的芳環旁側給/吸電子基團情況可見參底下這張大表,從上向下,總體上給電子能力漸弱吸電子能力漸強:
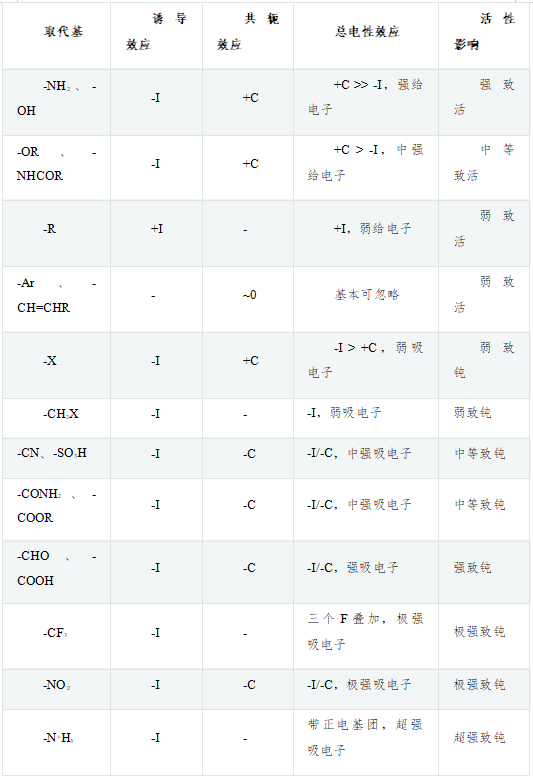
這里比較有趣的是表中第四行-Ar、-CH=CHR這樣的基團,主體都是碳原子,也都采取sp2雜化,誘導效應基本可以忽略。與芳環共軛時,每個碳也都是出一個p電子,通常也不會使得芳環電子云密度上升(表中用~0標記)。既然其基本不影響芳環上的電子云密度,為何還是弱致活的基團呢?主要原因是它們可以擴大反應中間體的共軛體系,使得中間體穩定性上升進而使反應活化能下降。具體可參見下面定位效應中對反應中間體的討論。
關于芳環旁側基團共軛給/吸電子的判斷,一般來說有如下規律:基團中原子提供2個電子參與共軛(典型如-NH2、-OH、-OR),提供的π電子數高于原本芳環的平均值(每原子1個),通常+C;含雜原子的基團中每原子平均提供1個電子參與共軛(典型如羰基-C=O,碳氧間π鍵一對電子與芳環共軛,碳氧兩個原子平均一人一個),由于雜原子電負性的關系,共軛體系離域電子容易向雜原子一側集中,通常-C;不含雜原子的基團中每原子平均提供1個電子參與共軛(典型如烯基-C=C),通常既無+C也無-C;基團中原子提供0個電子參與共軛(既僅有空的p軌道,硝基接近于此情形,但不完全一樣),低于原本芳環的平均值,通常強烈的-C。
2.對定位的影響
既有基團對苯環上后繼親電取代反應的位置也有影響,一部分基團會使后繼反應主要發生在自己鄰對位,即所謂的鄰對位定位基;而另一部分基團相反, 使后繼反應主要發生在自己的間位,我們稱為間位定位基。一般給電子的致活基團都是鄰對位定位基,而吸電子的致鈍基團大多數都是間位定位基,活性與定位之間似乎存在著明顯的關聯性。之所以如此,還是與反應機理有關。我們知道苯環上發生的親電取代反應實際分兩步走,首先發生的是類似于烯烴的親電加成,缺電子試劑對苯環中某個碳原子進攻,導致經典結構式中一根雙鍵打開,形成碳正離子:
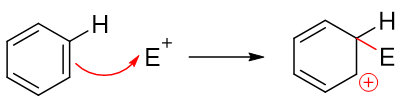
注意到當前的這種碳正離子明顯可以和旁側兩根雙鍵形成共軛體系,我們還是可以寫出一系列共振極限式表達其結構,其實際結構如右側所示,是個五中心共軛的正離子:
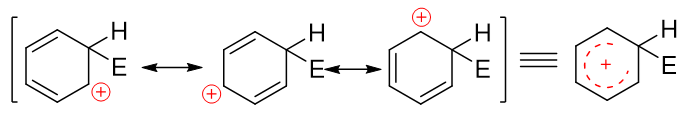
而后第二步相當于發生消除,脫除該碳原子上的H,C-H間一對電子轉移到C-C之間,仿佛是恢復了經典結構式中的雙鍵:
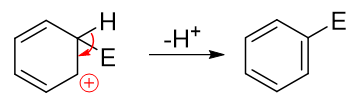
這兩步的串聯反應,第二步從正離子變成電中性的分子,而且恢復了苯環這么個具有芳香性的結構,明顯較易發生,活化能低。反之第一步需要破壞芳香性結構,生成正離子,活化能較高,是整個反應的速控步。親電取代反應的各種特征也就主要與第一步反應,尤其是第一步生成的正離子中間體有著極為密切的關聯。
以上是孤立苯環的反應情況。若事先環上已連接有一基團A,進攻試劑進攻A的鄰、對、間位(即相當于與下圖中經典結構式藍色標記處的雙鍵發生親電加成),第一步形成的正離子中間體及其共振式情況如下圖所示:
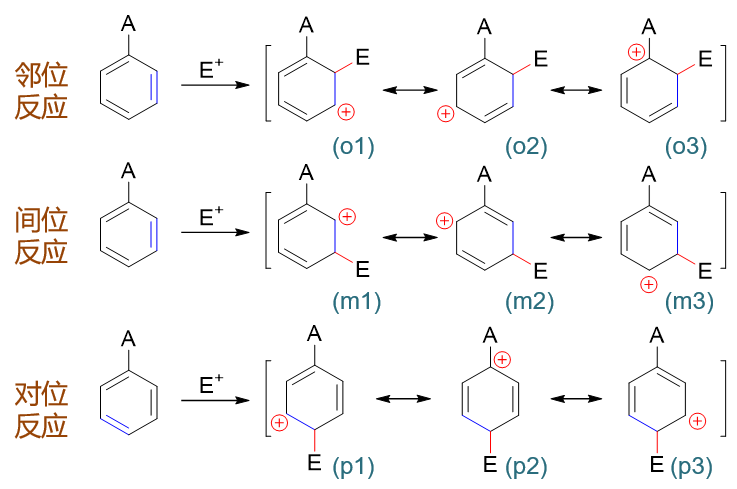
在這一系列共計三組九個共振極限式中,請大家特別注意鄰位取代的(o3)與對位取代的(p2):
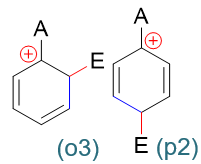
這倆共振極限式結構上有個明顯的特征:正電中心與環上的原有基團A緊挨在一起,受A的影響特別大。而間位取代的三個共振極限式中均不會出現類似的情況。
接下來我們引入電性效應。如果原有基團A具有給電子效應,則當其與正電中心相鄰時,把電子向正電中心推,無疑會使(o3)與(p2)的穩定性上升。而我們也知道,分子、離子實際結構相當于多個共振式的平均化,現在(o3)與(p2)的能量下降了,無疑會使鄰、對位取代生成的中間體實際結構能量也因之降低。反過來間位取代中間體的正電中心總是距離給電子基A較遠,享受不到這個待遇,實際結構能量上要比鄰對位的來得高些。換而言之,反應過程中鄰對位的中間體更容易形成,反應也就大量生成鄰對位取代產品。所以我們看到,只要是給電子基團,無一例外都是鄰對位定位基。
反過來如果A具有吸電子效應,則情況恰好相反,(o3)與(p2)的穩定性將下降,導致鄰對位取代中間體的能量上升。而間位取代中間體由于正電中心與吸電子基相對較遠,反而會更為穩定,反應也更容易延著間位取代的途徑進行。于是我們看到,絕大部分吸電子基都是間位定位基。
當然這里也有個例外:鹵素原子。之前討論活性的影響時,我們已經了解它的-I>+C,整體吸電子。但在定位上,偏偏它又是鄰對位定位基。這看起來似乎有些矛盾,但其實我們也不難理解。這里不妨將鹵苯分子以及親電取代反應第一步形成的共振極限式(o3)、(p2)列在一起比較:
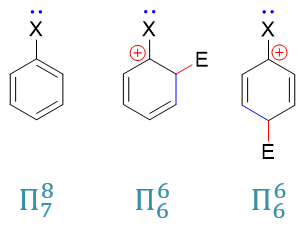
之前的鹵苯,形成的是電中性的Π78共軛體系,粗略里看共軛后平均每個原子分到8/7個π電子(當然實際電子云分布不會這么平均,只是粗略看)。而共軛之前,鹵素p軌道上是兩個電子,也就是說它在這里相當于給出了(2 - 8/7) = 6/7個電子。
而親電取代形成的正離子中間體(o3)與(p2),我們不難計算出它們各自都是Π66共軛體系,平均每個原子1個π電子。鹵素在這兒相當于給出了(2 - 1) = 1個電子。通過+C效應,明顯這里比電中性的鹵苯分子里給出的電子更多。尤其當前兩個共振式鹵素都是與正電中心直接相連,電子更是容易向正電中心流動。
原本電中性鹵苯分子里-I也就是略大于+C,鹵素與電中性碳相連時僅僅是一個弱吸電子基團。現在在與碳正相連時,鹵素通過共軛效應給出了更多的電子,情況自然也就發生了翻轉,這里相當于+C反過來大于-I了。與正電中心相連時,鹵素原子反倒會轉變成一個給電子的基團,能夠幫助正離子提高穩定性。
此外引入了第四個共振極限式解釋這個現象。如下圖所示,在(o3)與(p2)的基礎上,我們可以人為地令鹵素上一對孤對電子轉移到 C-X之間形成π鍵。由于這根π鍵兩個電子都來自于鹵素,比起正常共價鍵相當于碳原子多接受一個電子,于是碳上的正電荷消失,而鹵素相當于多給出一個電子帶有正電荷。得到的新的鹵素帶正電荷的共振極限式里所有的C、X原子均滿足八隅體結構,因而穩定性相對較強。
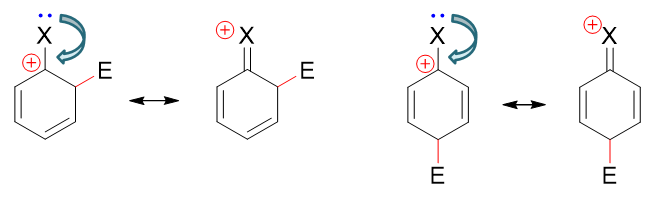
這種共振論的解釋與之前我們通過電性效應的理解基本是一體兩面,同一個現象的不同解釋手段。尤其穩定性較強的共振極限式,鹵素帶正電荷,其實也是在暗示與碳正中心相連時,鹵素的共軛效應會給出更多的電子。
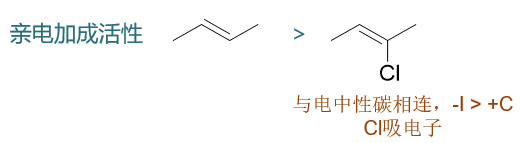
從鹵苯的例子,我們也應該更能理解本文一開始提出的觀點:致活致鈍看反應前的分子體系,而定位效應則關注反應中的形成的正離子中間體。鹵素原子給/吸電子效應的變化其它一些反應中也同樣能夠體現出來。比如烯烴的親電加成,下圖中兩個結構類似的烯烴,右側2-氯-2-丁烯電中性雙鍵碳上連接了氯原子,而此時Cl整體體現出吸電子效應,導致雙鍵電子云密度下降,其親電加成活性也就低于左側的烯烴:
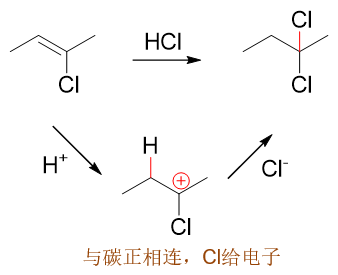
但2-氯-2-丁烯發生反應時,碳正離子卻更容易在2-位氯原子旁側形成,原因我們也已經了解了,與正電中心相連時,鹵素將轉而具有推電子效應,有利于碳正離子穩定,最終主要產品也將是2,2-二氯丁烷:
最后,我們再來解釋之前的-Ar、-CH=CHR這樣的芳基或者烯基為什么是弱致活的基團,同時也是鄰對位定位基。其實原理上與鹵苯類似。這兒我們就以最簡單的乙烯基為例,同樣還是把焦點放在正電中心與定位基緊挨著的(o3)與(p2)這樣的共振極限式上,這里把它們和反應前的電中性底物分子列在一起,計算共軛體系的π電子數目:
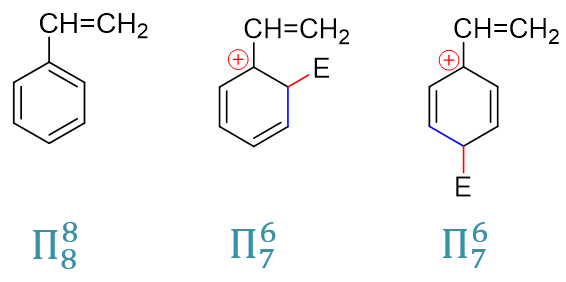
反應前的電中心分子,Π88共軛體系,平均每個原子分到一個p電子,與單純的苯或者單純的乙烯相比,各原子上電子云密度 基本沒發生什么變化。而反應形成正離子中間體后,我們注意到形成的是Π76體系,粗略里看平均每人6/7個,乙烯基的兩個碳原子, 這里相當于都給出了(1 - 6/7) = 1/7個電子。也就是說,類似于之前的鹵素,當與正電中心相連時,乙烯基通過共軛相當于給出了電子。于是 這兩個正電中心與乙烯基直接相連的共振極限式能量也因之顯著下降,反應過程中更易形成。烯基或芳基,定位效應上也就是鄰對位定位基。
此外,這里若沒有乙烯基,單純就是苯環,親電取代時形成的是Π54共軛體系。我們知道一般共軛體系越大能量上也越低,這里同樣也是如此。乙烯基苯親電取代時的Π76中間體能量要更低些,相應地,乙烯基苯這一步反應的活化能也較單純的苯來得低,速率更快。因此烯基或芳基,雖說反應前基本不改變芳環上的電子云密度,但依然具有弱活化作用。
3.利用定位規則合成苯衍生物
在化工與藥物生產活動中,經常需要合成一些多取代的苯衍生物。而這類分子的合成通常都與苯環親電取代的定位規則有關,各個基團按什么樣的次序引入苯環,引入過程中是否需要進行必要的官能團轉換,都是值得斟酌的事兒。在這里我們由易到難,來考查合成中的一些實例。
例1:請由苯出發合成間硝基氯苯。
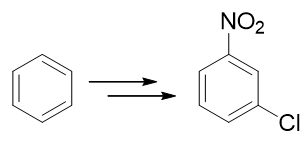
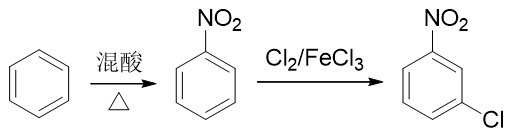
硝基與鹵素原子,分別可以通過硝化與親電鹵代反應引入芳環。這里只需要稍微留意一下先后次序。如果先做親電鹵代,從苯合成氯苯,再進行硝化,則由于鹵素原子是特殊的吸電子鄰對位定位基,最終主要產品將是鄰硝基氯苯與對硝基氯苯,與合成要求不符:

因此我們只能顛倒次序,先進行硝化,制備出硝基苯。硝基剛好是間位定位基,接下來做鹵代即可以大量生成目標分子:
例2:請由苯出發合成間乙基苯磺酸。
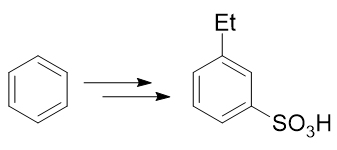
苯環上需要引入磺酸基、乙基兩個基團。前者自然可以使用濃硫酸磺化,后者也很容易讓我們聯想到傅克烷基化反應。如果先做傅克得到乙苯,乙基是個鄰對位定位基,接下來磺化時無疑無法大量生成間位取代產物:
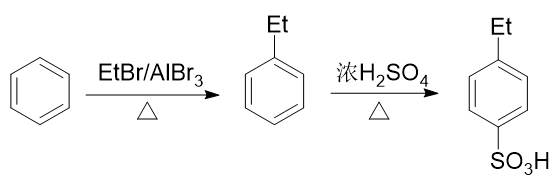
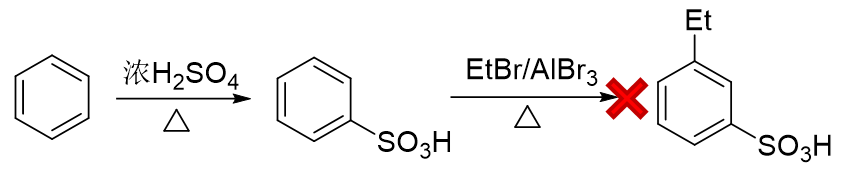
而反過來先磺化生成苯磺酸,看起來似乎磺酸基是個間位定位基,再來烷基化,乙基剛好可以進入磺酸基間位。但千萬別忘了傅克反應對芳環上電子云密度有比較苛刻的要求,當前苯環上連接磺酸基這么一個較強的吸電子基,傅克反應實際上難以發生:
無論先上哪個基團都不成,看起來似乎有點兒山窮水盡的意思。但在合成中我們其實可以稍微靈活些,不同的基團間實際是可以相互轉化的。比如目標分子中的乙基,在有機合成里其實很容易從乙酰基(-COMe)轉化過來。在后面醛酮 一章中我們會接觸經典的Clemmenson還原反應,使用鋅汞齊在酸性環境中可以把羰基還原成烷基:
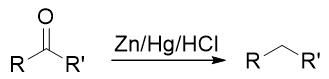
也就是說,如果使用這個反應,目標分子其實可以來自于間乙酰基苯磺酸:
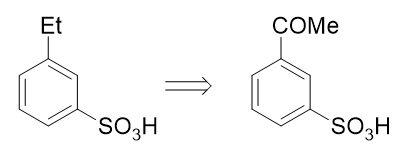
而看到間乙酰基苯磺酸,大家立馬就能找到思路了:先通過傅克酰化引入乙酰基,乙酰基剛好是間位定位基,再磺化,兩個 基團都能就位。于是我們可以寫出如下的整條合成路線:
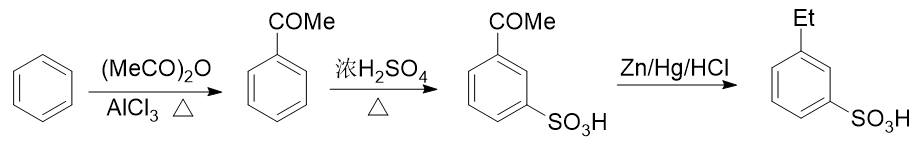
利用Clemmenson還原,將酰基與烷基聯系起來,是合成中常見的一個技巧。尤其是涉及苯衍生物的合成,由于 傅克烷基化容易發生重排、多取代等副反應,為了追求較高的產率,即便是制備烷基苯,我們也經常會使用先酰化再還原的手法。
例3:請由苯胺出發制備鄰硝基苯胺。
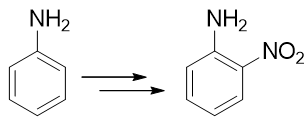
本例看起來很簡單,氨基恰好是個強給電子的鄰對位定位基,似乎直接混酸硝化就能生成產品。但真這么做的話產率一般不會高。 很重要的一個原因是由于氨基的強給電子能力,這導致苯胺的苯環上電子云密度特別高。一般電子云密度越高的地方越容易被氧化,考慮到混酸里硫酸、硝酸都具有比較強的氧化性,很可能我們希望的親電取代還沒發生,苯胺就已經被氧化掉了。
因此在合成時,我們需要盡力去避免這樣的氧化反應的發生。怎樣避免也有個挺常見也挺直白的做法:既然苯胺是由于環上電子云密度過高導致容易被氧化,我們只需要試著稍稍降低環上的電子云密度,它的抗氧化能力應該就會增強。實驗室中為了達到這個效果, 經常使用乙酰氯或者乙酸酐先把氨基轉變成乙酰氨基(這個反應我們在后面羧酸衍生物、含氮化合物這兩章中會詳細介紹):
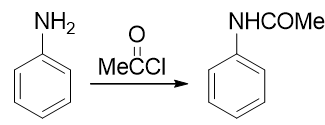
乙酰苯胺相當于是我們在氨基旁側又接上了一個吸電子的乙酰基。這首先會使氮原子上電子云密度有所下降,進而會使苯環上 電子云密度也沒有苯胺那么高,抗氧化能力大大增強,基本不會再為混酸所氧化了。當然,乙酰氨基整體上依然還是具有給電子 效應的,依然也還是個鄰對位定位基,定位性質上與氨基一般無二。
但由于乙酰氨基體積遠大于氨基,這又導致了一個新問題。我們接下來如果直接進行硝化反應,受位阻的影響,硝基將主要進入 乙酰氨基的對位,而不容易進入我們預期的鄰位:
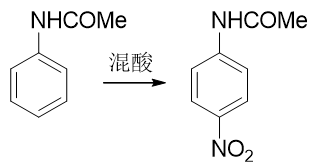
合成里處理這種問題我們又有一個比較通用的手段:可以別著急硝化,先利用其它的親電取代反應,在對位引入某個容易上去也容易下來的基團;接下來再硝化,這時由于對位已經被其它基團占據了,硝基無處可去,只能進入乙酰氨基鄰位;最后,再設法去除對位的占據基團,合成目標就可以達到。這種在苯衍生物合成中 常見的手法我們常稱之為“占位”。而最適合進行對位占位的,是我們熟悉的磺酸基。通過濃硫酸磺化,磺酸基很容易上去,而只需要在稀酸性條件下水解,磺酸基也很容易從芳環上脫下來。能上能下,能屈能伸,磺酸基的這個特性很容易讓我們寫出如下的合成路線來:
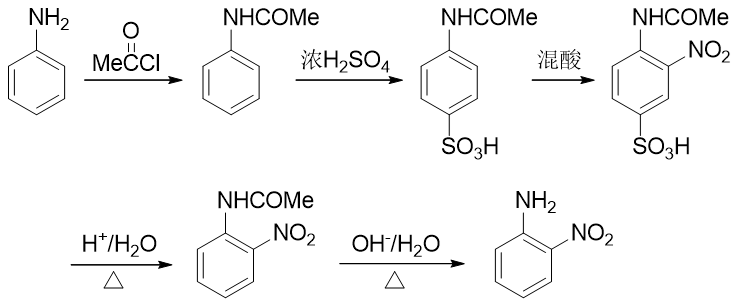
當然稀酸水解脫除磺酸基后,我們還需要把之前的乙酰氨基恢復成氨基。這里一般堿性條件水解就行(酸酸衍生物一章中我們會詳述酰胺這類分子的水解)。
例4:請由苯胺合成間溴苯胺。
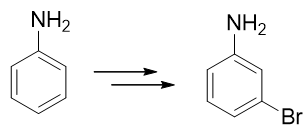
還是與苯胺有關,當前我們的目標是再引入一個溴原子——這當然需要利用親電鹵代反應。比較麻煩的是,這里氨基明顯是鄰對位 定位基,直接溴代位置不對。即便我們采取前例的做法,把氨基轉化成乙酰氨基,依然改變不了它的定位位置,同樣也行不通。
因此這提示我們,需要對氨基進行性質轉化,使其轉變為吸電子的間位定位基才成。如何轉化其實異常簡單:苯胺這類有機胺類 化合物的性質與無機氨相仿,也具有堿性(當然苯胺這樣的芳胺堿性比無機氨要弱一些)。因此在較強的酸性環境下,苯胺的 氨基可以接受一個質子,轉變成銨正離子:
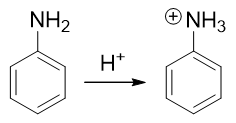
轉成銨正離子后,氮原子上直接帶了正電荷,必然不可能再向苯環那邊推電子了。相反,這種正離子一般都是極強的吸電子基團, 肯定是間位定位基,我們可以如愿進行鹵代:

最后在堿性環境下,把銨正離子恢復成氨基結構,合成就此完成。整條路線大致如下:
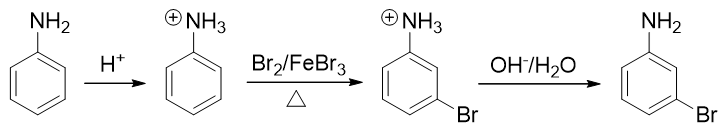
例5:請由鄰甲氧基苯酚出發合成5-硝基-2-甲氧基苯酚。

本題只需要再引入硝基這一個基團,但直接硝化明顯不太合適。注意到當前苯環上已有的羥基、甲氧基都是給電子的鄰對位定位基, 而且二者定位位置剛好不一致。這種情況下我們也知道,親電反應的主要位置將由更強的給電子基決定(這里是羥基)。因此 如果一上來就硝化,硝基將主要進入羥基的鄰對位,而無法大量得到進入甲氧基對位的目標產品。
因此這暗示我們,還得對既有基團事先做一定的轉化。一個比較容易想到的思路是:既然當前羥基給電子能力更強導致得不到目標產品,我們可以把羥基轉變成一個給電子能力弱于甲氧基的新基團,接下來再硝化,硝基就可以就位。要讓羥基做這種轉變,合成里一個常見的方法其實也是酰化(與之前我們看到的苯胺的例子類似)——將羥基轉變成酯基:
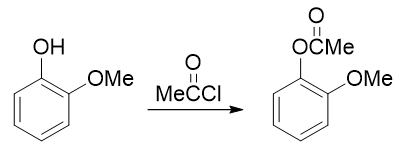
注意醇羥基酯化我們可以使用羧酸的酯化反應,但酚羥基不行,通常需要用到活性比羧酸更高的酰鹵或者酸酐。轉成酯基后,相當于羥基氧旁側接了一個吸電子的酰基,整體給電子能力將明顯弱于甲氧基了。我們接下來放心進行硝化,硝基可以進入預期位置:
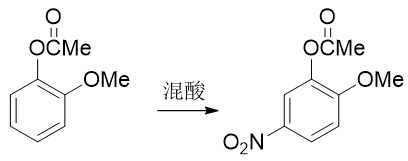
最后還得把酯基恢復成羥基。這個反應我們也不陌生:酯水解就成。酯水解通常在堿性條件下進行,而酚羥基酸性不弱,此時會得到苯氧基負離子。最終還需要酸化使之恢復成酚羥基

整個合成路線如下圖所示:
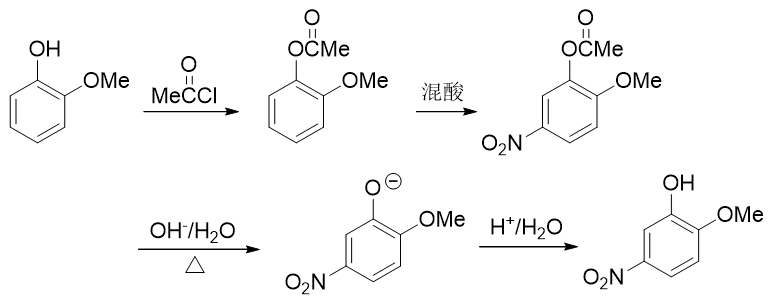
總之,苯衍生物的合成中,為了在苯環上引入新基團,我們經常會使用親電取代反應。而大凡使用親電取代,請一定注意定位規則,必要的時候需要對基團進行轉化,改變它的給/吸電子能力。








 客服QQ
客服QQ